Introducción
Los enlaces sigma (σ) y pi (π) son dos tipos fundamentales de enlaces covalentes que describen cómo los átomos comparten electrones para formar moléculas.
En este artículo, exploraremos las 10 principales diferencias entre enlace sigma y enlace pi, destacando sus definiciones, características y contextos de aplicación. Comprender estas diferencias es crucial para la adecuada interpretación de las propiedades y comportamientos de los compuestos químicos.
Diferencias
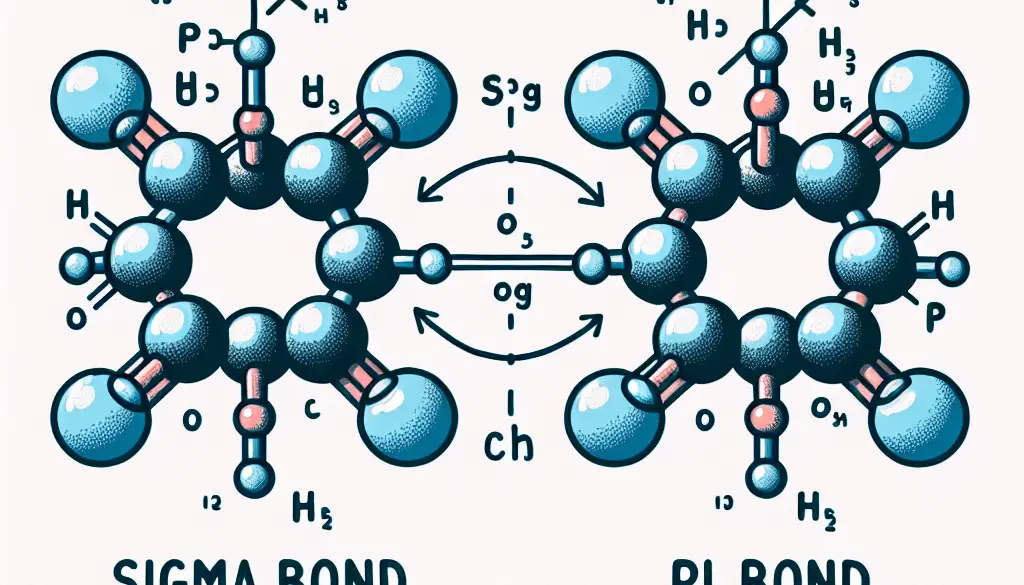
- Definición básica: Enlace sigma (σ) es un tipo de enlace covalente que se forma por la superposición frontal de orbitales atómicos. Enlace pi (π) es un tipo de enlace covalente que se forma por la superposición lateral de orbitales p.
- Superposición de orbitales: En un enlace sigma, los orbitales atómicos se superponen de manera frontal a lo largo del eje internuclear. En un enlace pi, los orbitales p se superponen de manera lateral, por encima y por debajo del plano del eje internuclear.
- Formación del enlace: Los enlaces sigma pueden formarse entre diferentes tipos de orbitales, incluidos s-s, s-p, p-p y híbridos. Los enlaces pi solo se forman entre orbitales p no híbridos.
- Fuerza del enlace: Los enlaces sigma son generalmente más fuertes que los enlaces pi debido a la mayor superposición frontal de los orbitales. Los enlaces pi son más débiles debido a la superposición lateral menos eficiente.
- Rotación molecular: Los enlaces sigma permiten la rotación libre alrededor del eje del enlace. Los enlaces pi restringen la rotación debido a la superposición lateral de los orbitales p.
- Presencia en moléculas: En una molécula con múltiples enlaces, el primer enlace entre dos átomos es siempre un enlace sigma. Los enlaces adicionales entre los mismos átomos son enlaces pi (por ejemplo, en un doble enlace, hay un enlace sigma y un enlace pi).
- Distribución de electrones: En un enlace sigma, la densidad electrónica está concentrada a lo largo del eje internuclear entre los dos núcleos atómicos. En un enlace pi, la densidad electrónica está distribuida por encima y por debajo del plano del eje internuclear.
- Formación en diferentes enlaces: Los enlaces sigma se encuentran en enlaces simples, dobles y triples. Los enlaces pi se encuentran únicamente en dobles y triples enlaces, acompañando a un enlace sigma.
- Hibridación: Los enlaces sigma pueden involucrar orbitales híbridos (sp, sp2, sp3). Los enlaces pi involucran solo orbitales p no hibridados.
- Ejemplos concretos: Un enlace sigma se encuentra en el enlace simple de una molécula de etano (C-C). Un enlace pi se encuentra en el doble enlace de una molécula de eteno (C=C), donde un enlace es sigma y el otro es pi.
Conclusión
En resumen, los enlaces sigma y pi son dos tipos distintos de enlaces covalentes que describen cómo los átomos comparten electrones para formar moléculas.
Los enlaces sigma se forman por la superposición frontal de orbitales atómicos y permiten la rotación libre, mientras que los enlaces pi se forman por la superposición lateral de orbitales p y restringen la rotación. Comprender estas diferencias es crucial para la adecuada interpretación de las propiedades y comportamientos de los compuestos químicos.
Para finalizar, te presentamos una tabla de resumen de diferencias:
| Aspecto | Enlace Sigma (σ) | Enlace Pi (π) |
|---|---|---|
| Definición básica | Superposición frontal de orbitales atómicos | Superposición lateral de orbitales p |
| Superposición de orbitales | Superposición frontal | Superposición lateral |
| Formación del enlace | s-s, s-p, p-p, híbridos | Solo orbitales p no híbridos |
| Fuerza del enlace | Más fuerte | Más débil |
| Rotación molecular | Permite rotación libre | Restringe la rotación |
| Presencia en moléculas | Enlaces simples, dobles y triples | Solo en dobles y triples enlaces |
| Distribución de electrones | Densidad electrónica a lo largo del eje internuclear | Densidad electrónica por encima y por debajo del eje internuclear |
| Formación en diferentes enlaces | Presente en enlaces simples, dobles y triples | Solo en dobles y triples enlaces |
| Hibridación | Involucra orbitales híbridos | Involucra solo orbitales p no hibridados |
| Ejemplos concretos | Enlace simple en etano (C-C) | Enlace pi en eteno (C=C) |
Esta tabla ofrece una visión clara de las diferencias clave entre enlace sigma y pi, ayudando a comprender sus características y contextos distintivos

