Introducción
Los enlaces covalentes son un tipo fundamental de enlace químico en el cual los átomos comparten electrones.
En este artículo, exploraremos las 10 principales diferencias entre enlace covalente polar y no polar, destacando sus definiciones, características y contextos de aplicación.
Comprender estas diferencias es crucial para la adecuada interpretación de las propiedades y comportamientos de los compuestos químicos.
Diferencias
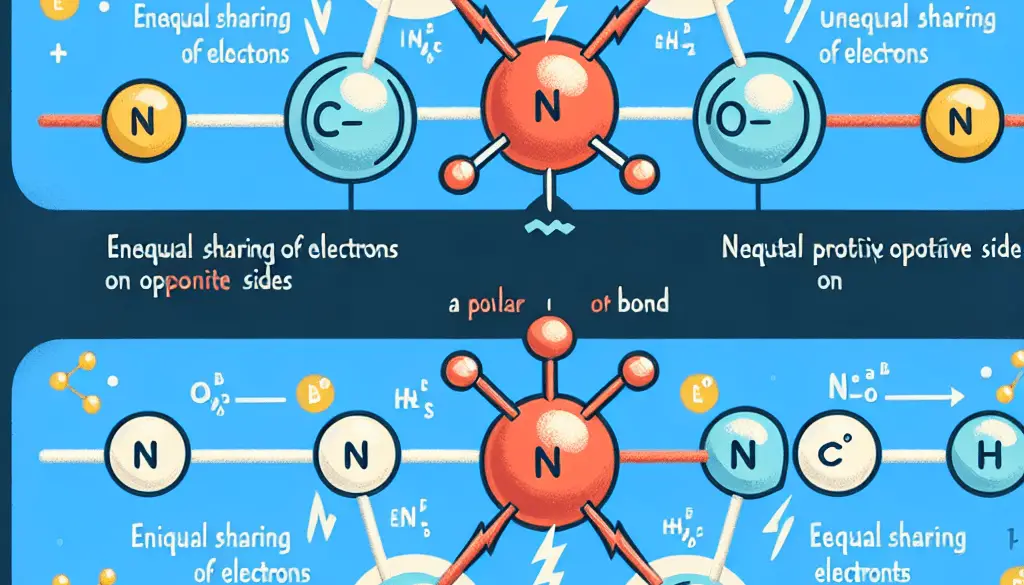
- Definición básica: Enlace covalente polar se forma cuando los electrones se comparten de manera desigual entre dos átomos, generando una distribución asimétrica de la densidad electrónica. Enlace covalente no polar se forma cuando los electrones se comparten de manera equitativa entre dos átomos, resultando en una distribución simétrica de la densidad electrónica.
- Electronegatividad: En un enlace covalente polar, los átomos involucrados tienen diferencias significativas en su electronegatividad (mayor a 0.4). En un enlace covalente no polar, los átomos tienen electronegatividades similares o iguales (diferencia menor o igual a 0.4).
- Distribución de carga: En los enlaces covalentes polares, se forma una distribución asimétrica de la carga eléctrica, con una región parcialmente negativa y una región parcialmente positiva. En los enlaces covalentes no polares, la carga eléctrica se distribuye de manera uniforme entre los átomos.
- Momento dipolar: Los enlaces covalentes polares tienen un momento dipolar neto debido a la separación de cargas parciales positivas y negativas. Los enlaces covalentes no polares no tienen un momento dipolar neto, ya que las cargas están distribuidas uniformemente.
- Solubilidad: Los compuestos con enlaces covalentes polares tienden a ser solubles en disolventes polares (como el agua). Los compuestos con enlaces covalentes no polares tienden a ser solubles en disolventes no polares (como el hexano).
- Propiedades físicas: Los compuestos con enlaces covalentes polares suelen tener puntos de ebullición y fusión más altos que los compuestos con enlaces covalentes no polares, debido a las interacciones dipolo-dipolo. Los compuestos con enlaces covalentes no polares tienen puntos de fusión y ebullición más bajos debido a las fuerzas de dispersión de Van der Waals.
- Ejemplos concretos: Un ejemplo de un compuesto con enlaces covalentes polares es el agua (H₂O), donde el oxígeno es más electronegativo que el hidrógeno. Un ejemplo de un compuesto con enlaces covalentes no polares es el gas nitrógeno (N₂), donde los dos átomos de nitrógeno tienen la misma electronegatividad.
- Reactividad química: Los compuestos con enlaces covalentes polares tienden a ser más reactivos en reacciones químicas debido a la presencia de regiones de carga parcial. Los compuestos con enlaces covalentes no polares son generalmente menos reactivos.
- Conductividad eléctrica: Los compuestos covalentes polares pueden conducir electricidad en solución si se ionizan. Los compuestos covalentes no polares no conducen electricidad, ya que no se disocian en iones.
- Interacciones intermoleculares: Los compuestos con enlaces covalentes polares pueden formar enlaces de hidrógeno y fuerzas dipolo-dipolo. Los compuestos con enlaces covalentes no polares solo experimentan fuerzas de dispersión de Van der Waals.
Conclusión
En resumen, los enlaces covalentes polares y no polares son dos tipos distintos de enlaces químicos que describen cómo los átomos comparten electrones.
Los enlaces covalentes polares se caracterizan por una distribución asimétrica de la densidad electrónica debido a diferencias en la electronegatividad de los átomos involucrados.
Los enlaces covalentes no polares se caracterizan por una distribución simétrica de la densidad electrónica debido a electronegatividades similares de los átomos. Comprender estas diferencias es crucial para la adecuada interpretación de las propiedades y comportamientos de los compuestos químicos.
Para finalizar, te presentamos una tabla de resumen de diferencias:
| Aspecto | Enlace Covalente Polar | Enlace Covalente No Polar |
|---|---|---|
| Definición básica | Electrones compartidos de manera desigual | Electrones compartidos de manera equitativa |
| Electronegatividad | Diferencias significativas (mayor a 0.4) | Electronegatividades similares o iguales (menor o igual a 0.4) |
| Distribución de carga | Asimétrica, con cargas parciales positivas y negativas | Simétrica, con carga uniforme |
| Momento dipolar | Presente | Ausente |
| Solubilidad | Solubles en disolventes polares | Solubles en disolventes no polares |
| Propiedades físicas | Puntos de fusión y ebullición más altos | Puntos de fusión y ebullición más bajos |
| Ejemplos concretos | Agua (H₂O) | Nitrógeno (N₂) |
| Reactividad química | Más reactivos | Menos reactivos |
| Conductividad eléctrica | Pueden conducir electricidad en solución | No conducen electricidad |
| Interacciones intermoleculares | Enlaces de hidrógeno, fuerzas dipolo-dipolo | Fuerzas de dispersión de Van der Waals |
Esta tabla ofrece una visión clara de las diferencias clave entre enlace covalente polar y no polar, ayudando a comprender sus características y contextos distintivos.

