Introducción
En este artículo, exploraremos las 10 principales diferencias entre vaporización y ebullición.
Estos términos describen procesos relacionados con el cambio de estado de una sustancia líquida a gaseosa, pero tienen características y condiciones diferentes que los distinguen. Entender estas diferencias es fundamental para diversas aplicaciones en la ciencia y la ingeniería, así como para comprender fenómenos cotidianos.
En este artículo, exploraremos las 10 principales diferencias entre vaporización y ebullición.
Diferencias
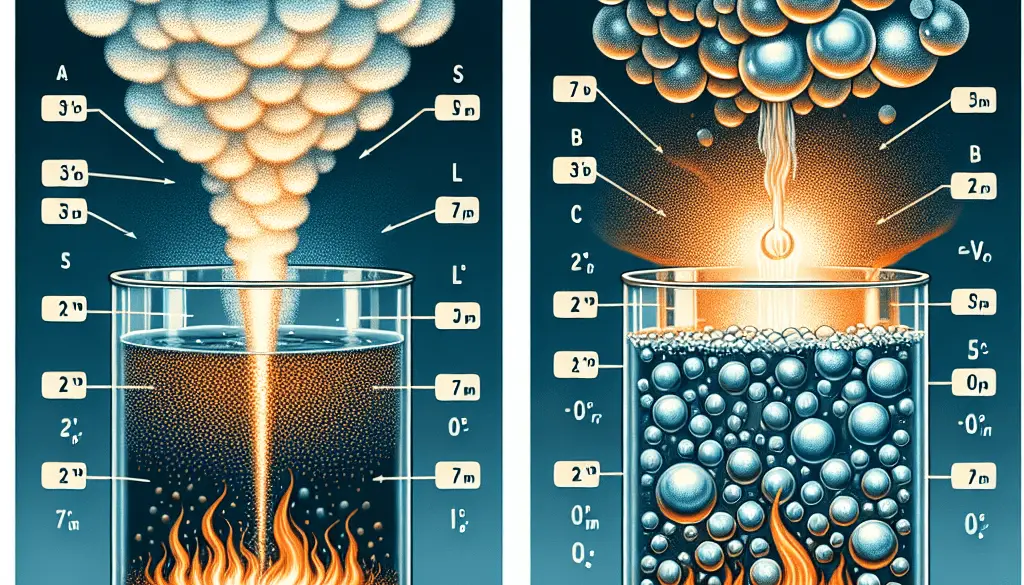
- Definición del proceso: La vaporización es el proceso general mediante el cual un líquido se transforma en gas y puede ocurrir en cualquier temperatura. La ebullición, por otro lado, es un tipo específico de vaporización que ocurre cuando un líquido se calienta hasta su punto de ebullición y el cambio de fase ocurre en todo el volumen del líquido, no solo en la superficie.
- Condiciones de temperatura: La vaporización puede ocurrir a cualquier temperatura, siempre que las moléculas en la superficie del líquido tengan suficiente energía para superar las fuerzas intermoleculares. La ebullición, en contraste, ocurre a una temperatura específica para cada sustancia, conocida como el punto de ebullición, cuando la presión del vapor del líquido iguala la presión externa.
- Ubicación del proceso: En la vaporización, el cambio de fase generalmente ocurre solo en la superficie del líquido. En la ebullición, el proceso ocurre en toda la masa del líquido, con burbujas de vapor formándose y ascendiendo desde el interior del líquido hacia la superficie.
- Velocidad del proceso: La vaporización es un proceso relativamente lento ya que depende de la energía de las moléculas individuales en la superficie del líquido. La ebullición es un proceso mucho más rápido ya que se produce en todo el volumen del líquido de manera uniforme una vez alcanzada la temperatura de ebullición.
- Presión del vapor: Durante la vaporización, la presión del vapor sobre el líquido puede ser menor que la presión atmosférica. En la ebullición, la presión del vapor del líquido debe ser igual a la presión externa para que las burbujas de vapor se formen dentro del líquido y suban a la superficie.
- Energía necesaria: La vaporización requiere menos energía que la ebullición porque ocurre gradualmente y solo afecta a las moléculas de la superficie. La ebullición requiere una cantidad considerable de energía para calentar todo el líquido hasta su punto de ebullición y para mantener el cambio de fase en todo el volumen del líquido.
- Aplicaciones prácticas: La vaporización es importante en procesos como la evaporación, que juega un papel crucial en la regulación de la temperatura corporal a través del sudor y en el ciclo del agua en la naturaleza. La ebullición se utiliza comúnmente en la cocina, esterilización de equipos médicos y en la generación de energía en plantas termoeléctricas.
- Ejemplos cotidianos: Un ejemplo de vaporización es el secado de ropa al aire libre, donde el agua se evapora gradualmente a temperaturas inferiores al punto de ebullición. La ebullición se observa cuando se hierve agua en una olla, donde el agua se calienta hasta alcanzar su punto de ebullición y burbujea vigorosamente.
- Influencia de la presión: La vaporización se ve menos afectada por cambios en la presión externa ya que ocurre principalmente en la superficie del líquido. La ebullición está altamente influenciada por la presión externa; en altitudes más altas, donde la presión atmosférica es menor, el punto de ebullición del agua disminuye.
- Fenómenos relacionados: La vaporización está estrechamente relacionada con la evaporación y la sublimación (cuando un sólido pasa directamente a gas). La ebullición se relaciona específicamente con la transición de líquido a gas a una temperatura y presión específicas, y se observa en fenómenos como el punto de ebullición y la destilación.
Conclusión
En resumen, aunque la vaporización y la ebullición son procesos relacionados con el cambio de estado de líquido a gas, presentan diferencias significativas en términos de condiciones de temperatura, ubicación del proceso, velocidad, presión del vapor, energía necesaria, aplicaciones prácticas, ejemplos cotidianos, influencia de la presión y fenómenos relacionados.
Entender estas diferencias es fundamental para diversas aplicaciones científicas e industriales, así como para comprender mejor los fenómenos que observamos en la vida diaria.
Para finalizar, te presentamos un resumen de las diferencias entre vaporización y ebullición:
| Aspecto | Vaporización | Ebullición |
|---|---|---|
| Definición del proceso | Cambio de líquido a gas en cualquier temperatura | Cambio de líquido a gas a una temperatura específica |
| Condiciones de temperatura | Puede ocurrir a cualquier temperatura | Ocurre al punto de ebullición |
| Ubicación del proceso | Superficie del líquido | Todo el volumen del líquido |
| Velocidad del proceso | Relativamente lento | Rápido |
| Presión del vapor | Puede ser menor que la presión atmosférica | Igual a la presión externa |
| Energía necesaria | Menos energía necesaria | Más energía necesaria |
| Aplicaciones prácticas | Evaporación, regulación de temperatura corporal | Cocina, esterilización, generación de energía |
| Ejemplos cotidianos | Secado de ropa al aire | Hervir agua en una olla |
| Influencia de la presión | Menos afectada por la presión externa | Altamente influenciada por la presión externa |
| Fenómenos relacionados | Evaporación, sublimación | Punto de ebullición, destilación |
Esperamos que este artículo te haya proporcionado una comprensión clara de las diferencias entre estos dos procesos y te ayude a aplicar este conocimiento en contextos científicos y cotidianos.

