Introducción
Las sustancias que conforman el mundo material pueden organizarse de diversas maneras, dando lugar a estructuras con propiedades y comportamientos únicos.
En este artículo, exploraremos las 10 principales diferencias entre molécula y cristal.
Comprender estas diferencias es esencial para disciplinas como la química, la física y la ciencia de materiales, ya que influyen en el estudio de las propiedades y aplicaciones de los distintos compuestos.
Diferencias
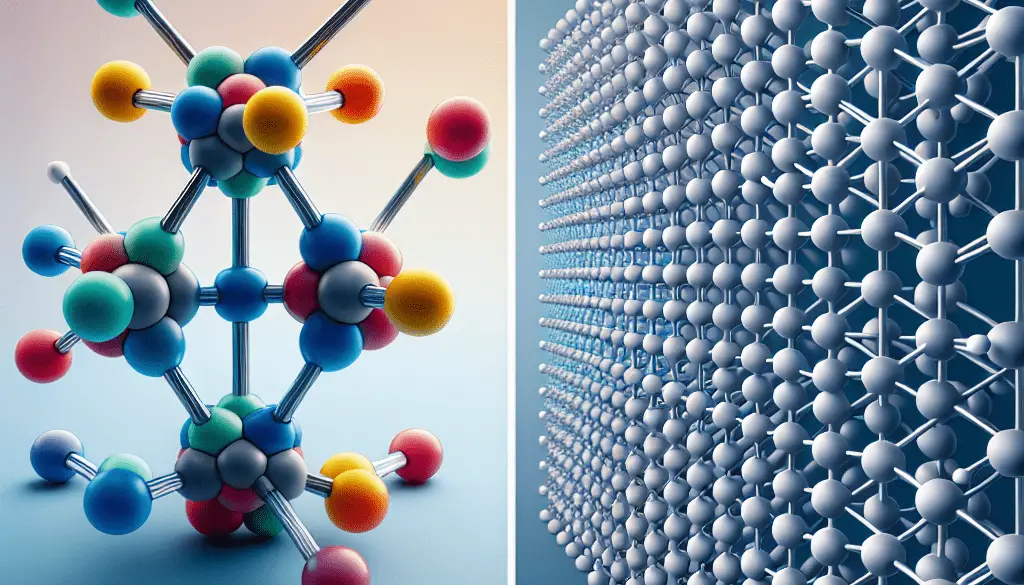
1. Definición básica:
- Molécula: Una molécula es una entidad química compuesta por dos o más átomos unidos por enlaces covalentes. Estas uniones pueden formar estructuras simples como el oxígeno diatómico (O₂) o complejas como las proteínas.
- Cristal: Un cristal es una estructura sólida en la que los átomos, moléculas o iones están organizados en un patrón repetitivo tridimensional. Esta disposición regular se extiende en todas las direcciones y se conoce como red cristalina.
2. Naturaleza de las uniones:
- Molécula: En una molécula, los átomos están unidos por enlaces covalentes que implican el compartimiento de electrones entre los átomos. Esto crea una estructura discreta y específica.
- Cristal: En un cristal, las unidades básicas pueden estar unidas por diversos tipos de enlaces, incluyendo enlaces covalentes, iónicos y metálicos. La fuerza y naturaleza de estos enlaces afectan las propiedades físicas del cristal.
3. Dimensiones y escala:
- Molécula: Las moléculas son entidades discretas y de tamaño limitado, generalmente medido en nanómetros. Cada molécula tiene una fórmula química definida y una estructura geométrica específica.
- Cristal: Los cristales pueden crecer hasta tamaños macroscópicos visibles a simple vista. No tienen un tamaño límite específico, ya que su estructura se repite indefinidamente en el espacio tridimensional.
4. Propiedades físicas:
- Molécula: Las propiedades físicas de una molécula dependen de su estructura y los enlaces entre sus átomos. Pueden ser gaseosas, líquidas o sólidas a temperatura ambiente, dependiendo de la fuerza de sus enlaces intermoleculares.
- Cristal: Los cristales tienen propiedades físicas que dependen de su estructura cristalina. Por ejemplo, los cristales iónicos son generalmente duros y tienen altos puntos de fusión, mientras que los cristales covalentes pueden ser extremadamente duros, como el diamante.
5. Propiedades ópticas:
- Molécula: Las moléculas pueden tener propiedades ópticas variadas, como la absorción de luz en ciertas longitudes de onda, lo que determina su color. Estas propiedades están determinadas por la estructura electrónica de la molécula.
- Cristal: Los cristales pueden exhibir propiedades ópticas únicas debido a la interacción de la luz con su estructura ordenada. Por ejemplo, los cristales pueden mostrar birefringencia, donde la luz se divide en dos rayos al pasar a través del cristal.
6. Formación y crecimiento:
- Molécula: La formación de moléculas ocurre a través de reacciones químicas que involucran la combinación de átomos y la formación de enlaces covalentes. Este proceso puede ser controlado y reproducido en laboratorio.
- Cristal: Los cristales se forman generalmente por procesos de nucleación y crecimiento, donde las unidades básicas se ensamblan de manera ordenada desde una fase líquida, gaseosa o fundida. La velocidad de crecimiento y las condiciones ambientales afectan la forma y tamaño del cristal resultante.
7. Estabilidad:
- Molécula: La estabilidad de una molécula depende de la energía de sus enlaces covalentes. Algunas moléculas son altamente estables, mientras que otras pueden reaccionar fácilmente bajo ciertas condiciones.
- Cristal: La estabilidad de un cristal está influenciada por la energía de la red cristalina y la interacción entre sus componentes. Algunos cristales son muy estables, como los minerales, mientras que otros pueden ser susceptibles a cambios de temperatura y presión.
8. Simetría y geometría:
- Molécula: Las moléculas pueden tener diferentes grados de simetría, dependiendo de la disposición de sus átomos. La simetría molecular afecta propiedades como la polaridad y la reactividad.
- Cristal: Los cristales poseen simetría a nivel macroscópico debido a la repetición periódica de su estructura. Existen diferentes sistemas cristalinos (cúbico, tetragonal, ortorrómbico, etc.) que definen la forma y las propiedades del cristal.
9. Usos y aplicaciones:
- Molécula: Las moléculas tienen aplicaciones diversas, desde componentes básicos en reacciones químicas hasta el diseño de fármacos y materiales funcionales. Su tamaño y propiedades específicas son claves en biología y medicina.
- Cristal: Los cristales se utilizan en una amplia gama de aplicaciones, incluyendo la electrónica (semiconductores), óptica (láseres, lentes), y materiales de construcción. Las propiedades mecánicas y eléctricas de los cristales son explotadas en tecnología y ciencia de materiales.
10. Ejemplos representativos:
- Molécula: Ejemplos de moléculas incluyen el agua (H₂O), el dióxido de carbono (CO₂), y las proteínas como la hemoglobina. Cada una tiene propiedades y funciones específicas basadas en su estructura.
- Cristal: Ejemplos de cristales incluyen el cloruro de sodio (NaCl), el diamante (C) y el cuarzo (SiO₂). Estos materiales tienen aplicaciones prácticas debido a sus propiedades físicas únicas derivadas de su estructura cristalina.
Conclusión
En resumen, las moléculas y los cristales representan dos formas fundamentales en las que los átomos pueden organizarse. Las moléculas son unidades discretas con enlaces covalentes específicos, mientras que los cristales son estructuras tridimensionales repetitivas con propiedades únicas.
En este artículo, exploramos las 10 principales diferencias entre molécula y cristal, destacando sus definiciones, propiedades y aplicaciones. Entender estas diferencias es crucial para aprovechar al máximo sus características en ciencia y tecnología.
Para finalizar, te presentamos un resumen de las diferencias:
| Diferencia | Molécula | Cristal |
|---|---|---|
| Definición básica | Entidad química con átomos unidos por enlaces covalentes | Estructura sólida con patrón repetitivo tridimensional |
| Naturaleza de las uniones | Enlaces covalentes | Enlaces covalentes, iónicos, metálicos |
| Dimensiones y escala | Tamaño limitado, estructuras discretas | Tamaño macroscópico, estructura infinita |
| Propiedades físicas | Varían según estructura y enlaces | Dependen de la red cristalina |
| Propiedades ópticas | Determinadas por estructura electrónica | Pueden mostrar birefringencia |
| Formación y crecimiento | Reacciones químicas | Nucleación y crecimiento controlado |
| Estabilidad | Depende de la energía de los enlaces | Influenciada por la energía de la red |
| Simetría y geometría | Grados de simetría variable | Simetría macroscópica definida |
| Usos y aplicaciones | Fármacos, materiales funcionales | Electrónica, óptica, materiales de construcción |
| Ejemplos representativos | Agua, dióxido de carbono, proteínas | Cloruro de sodio, diamante, cuarzo |

